RHESUS-BLUTGRUPPENSYSTEM
Das Rhesus-Blutgruppensystem ist mit Abstand das grösste. Es umfasst 55 verschiedene Antigene=Blutgruppen, die die Bildung von Antikörpern auslösen könnten. Das wichtigste Antigen in diesem System ist das D. Es ist nach wie vor die Hauptursache für den Morbus haemolyticus neonatorum. Deshalb sollte eine Transfusion von Rhesus positiven Blut an Mädchen und Frauen im gebärfähigen Alter, die selbst Rhesus negativ sind, nur im Rahmen einer vitalen Versorgung stattfinden. Weiters muss vorher natürlich festgestellt sein, dass eine solche Immunisierung nicht bereits stattgefunden habe. Eine Transfusion gegen ein anti-D kann ähnliche Folgen haben, wie eine inkompatible Transfusion im ABO-System.
Ansonsten dürfte man Männer und nicht gebärfähige Frauen, sowie männliche Kinder mit O+ (Rhesus positiv) versorgen. Aber auch das gilt NUR in dem Fall, dass
- ein echter Engpass bei den O- (Rhesus negativen) Erythrozytenkonzentraten besteht
- und/oder mit einem hohen Verbrauch zu rechnen ist
- oder es handelt sich um eine Vitalindikation und mir stehen keine Alternativen zur Verfügung.
Zum D gibt es kein antithetisches Antigen - Rhesus negativ bedeutet also, dass das große D fehlt.
Zu den klinisch relevanten Antigenen im Rhesussystem gehören C und das antithetische c, sowie das E und das antithetische e. Zueinander antithetische Antigene sind unterschiedliche Allele des gleichen Gens. Der Unterschied besteht fast immer in einem Nukleotidaustausch in der der Gensequenz. Ausserdem findet sich auf einigen C positiven Zellen ein anderes Antigen, das Cw genant wird. Diese Zellen sind meist, aber nicht immer Rhesus positiv.
Eigentlich sollte man bei den Hauptantigenen des Rhesussystems antigengleich transfundieren, aber es wird - wahrscheinlich aus finanziellen und sicher aus logistischen Gründen nicht gemacht. Hat ein Patient allerdings bereits einen Alloantikörper entwickelt, wird ab da die gesamte Resusformel (alle 5 Antigene, z.B.: CCDee) berücksichtigt - das wurde in den Richtlinien festgelegt.
Hier ist ein Beispiel für die klinische Bedeutung von erythrozytären Antikörpern.
(und IMMER vorausgesetzt der Patient hat noch KEINE irregulären Antikörper)
A positiv - es ist eine der häufigsten Blutgruppen und meist ohne Probleme zu versorgen
Was kann sich aber hinter dem Begriff A+ alles verbergen?
Da wir beim Rhesus bleiben wollen, lassen wir die Blutgruppe A, Blutgruppe A sein (da gibt es auch Varianten), aber beim Rhesus-Phänotyp gibt es viele Varianten, die trotzdem alle Rhesus positiv sind: ccDee (ziemlich selten), CCDee (häufig) CcDee (sehr häufig), CCDEE (sehr selten), CcDEe (relativ häufig), ccDEE (selten) - wer will, kann alle Möglichkeiten durchprobieren. Hier sehen wir schon, dass es beim Spender und Empfänger zu vielen Diskrepanzen kommen kann und bei jedem Antigen der Spendererythrozyten, kann der Empfänger, wenn er selbst das Antigen nicht besitzt, Antikörper dagegen bilden. Und dann kann ein simpler A pos Patient auch zum "Versorgungsproblem" werden.
Wir nehmen also den gleichen Patienten mit BG A positiv. Nur dass er diesmal bereits vortransfundiert ist und den Antikörper anti-e entwickelt hat. Spätestens jetzt wird der Phänotyp des Patienten untersucht.
Sein Rhesus-Phänotyp: ccDEE - nur 2% der Rhesus-positiven haben diesen Phänotyp.
Nachdem er schon einmal einen Antikörper entwickelt hat, ist die Wahrscheinlichkeit der Antikörperbildung gestiegen - statistisch gesehen und eigentlich aus Selbstbeobachtungen - kein Lehrbuchwissen.
Also wird man zunächst versuchen, ihn phänotypgleich - also ccDEE - zu transfundieren. Aber leider gibt es im Blutdepot nur zwei Erythrozytenkonzentrate mit diesem Rhesus-Phänotyp und davon hat ein EK bereits die BG O. Und der Chirurg braucht mindestens 4 EKs. Wenn man "Glück" hat, findet sich noch im Bestand eine Konserve mit CcDEE oder sogar ccddEE - Häufigkeiten jeweils 0,06% und < 0,01%.
Jetzt hat man den Patienten irgendwie mit nur zwei Erythrozytenkonzentraten über die OP gebracht, er erholt sich gut, nur das Blutbild will sich nicht normalisieren. Er bleibt konstant bei 7,4 g/dl und 22% Hämatokrit. Also bestellt der Stationsarzt für ihn zwei Erythrozytenkonzentrate.
Beim Antikörpersuchtest fällt aber auf, dass das Reaktionsmuster nicht zum anti-e allein passen kann. Also wird wieder eine Antikörperdifferenzierung durchgeführt und der Patient hat diesmal tatsächlich ein anti-C.
Mit diesen zwei Antikörpern, nur im Rhesussystem ist die weitere Versorgung nicht mehr so einfach. Er braucht jetzt wirklich Blut der BG A oder O mit dem Phänotyp ccDEE. Und man hofft, dass er nicht noch weitere Antikörper dazu entwickelt. Da will man eigentlich gar nicht an die 350 weitere Blutgruppen denken... bis jetzt sind wir ja nur im Rhesussystem geblieben.
Das ist übrigens genau eine Situation, bei der die Verabreichung von "Null negativ" - dem berühmten Universalspender, den Patienten in eine schwere Hämolyse schicken kann. Rhesus negativ bedeutet in der Regel ccddee und unser Patient hat anti-e Antikörper. Meist verursacht der Antikörper keine sofortige, intravasale Hämolyse. Trotzdem kann auch eine verzögerte, extravasale (Milz, Leber) Hämolyse zu schweren Störungen der Nierenfunktion und Bilirubinanstieg führen.
Aus diesem Grund versucht man die Transfusion von ungekreuzten Blutkonserven möglichst zu vermeiden. Jede so verabreichte Konserve wird "nachgekreuzt" - die Verträglichkeitsprobe mit dem Patientenserum, das unbedingt VOR der ersten Transfusion abgenommen werden muss, wird im Nachhinein durchgeführt. Bei einer positiven Kreuzprobe muss der Patient auf Hämolyse überwacht werden und gegebenenfalls entsprechend behandelt werden.
Jetzt drängt sich natürlich die Frage auf, warum man es nicht von Anfang an alle Antigene berücksichtigt - oder zumindest die "wichtigsten".
Bei großen Blutdepots (Innsbruck, Linz, Wien) wird zumindest bei Kindern und gebärfähigen Frauen genau so vorgegangen. Aber Krankenhäuser mit einem kleinem Depot werden solche EKs einfach nicht immer auf Lager haben.
Und dazu kommt auch, dass nur ca. 1-2% aller transfundierten Patienten tatsächlich auch Antikörper entwickeln. Gefühlsmäßig ist es bei Schwangerschaften etwas höher (nur mein Gefühl), aber auch hier werden in Wirklichkeit die meisten Schwangeren nie etwas von "Antikörpern" hören.
Arbeitet man in einer solchen Institution, bekommt man ganz automatisch das Gefühl: alle Patienten entwickeln Antikörper. Und jede Schwangere muss die volle Schwangerschaftsdauer um ihr Kind zittern.
Das liegt einfach daran, dass wir - Transfusionsmediziner - nur solche Patienten zu sehen bekommen - die anderen, ohne Antikörper, werden transfundiert und bekommen gesunde Babies, nur dass es an uns vorbeigeht :-).
VERTEILUNG IN DER BEVÖLKERUNG
In Europa sind 85% der Menschen Rhesus positiv und 15% Rhesus negativ
In Asien und in Afrika kommen Rhesus negative Menschen praktisch nicht vor! Die Menschen dort sind praktisch zu 100% Rhesus positiv!
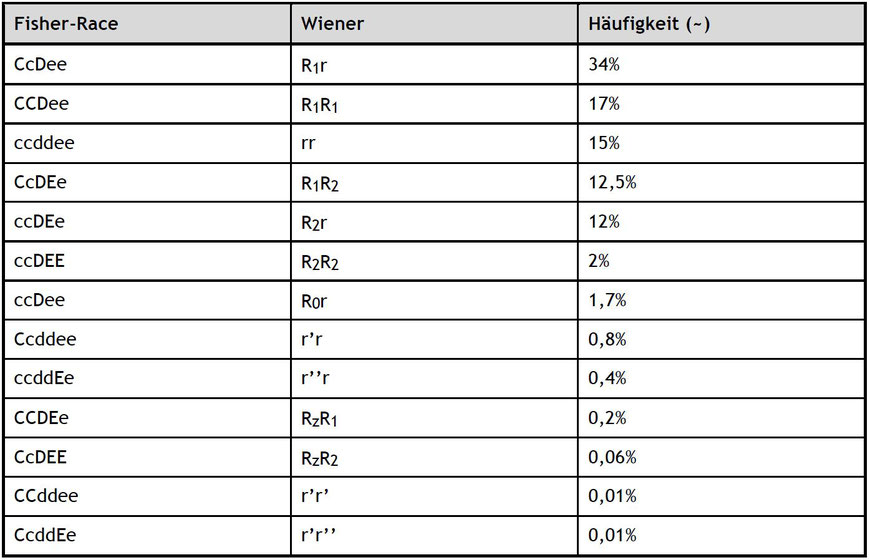
SCHREIBWEISE und Vererbung
Die in Europa verwendete Schreibweise des Phesusphänotyps/der Rhesusformel orientiert sich nach Fisher/Race.
Sie schreibt alle 5 oder 6 möglichen Antigene aus - mit einer Ausnahme beim RhD, wo es, wie wir es gelernt haben, nur ein Antigen gibt - wenn es fehlt, ist es einfach nicht da und es werden sozusagen "imaginäre" Antigene aufgeschrieben.
So können unterschiedliche Phänotypen (Rhesusformel) folgendermassen aussehen:
- ccddee - eindeutig RhD negativ - die zwei kleinen dd gibt es in Wirklichkeit nicht.
- Ccddee - RhD negativ ist zwar negativ, aber durch das Vorhandensein des großen Cs sind diese EKs "unbeliebt".
- CcD.ee - ist die häufigste Rhesusformel überhaupt - Rh positiv
Nach der amerikanischen Schreibweise nach Wiener, würden diese Phänotypen folgendermaßen aussehen:
- rr
- r'r
- R'r
Diese Schreibweise berücksichtigt die Haplotypen, also die von einem Elternteil vererbten Antigene. Diese werden als Einheit vererbt: Das RHCE und das RHD-Gen hängen zusammen. Das exprimierte Produkt von RHCE kann ce, cE, CE oder Ce sein. Dazu kommt dann jeweils das Produkt vom RHD-Gen - D, wenn es exprimiert wird und d, wenn es fehlt.
Der Haplotyp wird dann als Reihenfolge der drei Buchstaben dargestellt (der Einfachheitshalber in alphabetischer Reihenfolge):
cde, CDe, cDe u.s.w. Die in Europa gängige Schreibweise ccddee oder CCDee schmeißt beide Haplotypen zusammen - in dieser Darstellung ist nicht klar, welches Antigen zu welchem Haplotyp gehört. Aber auch die amerikanische Darstellung ist oft nur eine Statistische Wahrscheinlichkeit, wie der Haplotyp aussehen müsste.
Ein Beispiel:
CcDee würde R'r heißen.
Dabei wird folgendes angenommen: 1. Haplotyp: CDe, 2. Haplotyp: cde.
Das sind die Häufigsten zwei, die zu dieser Kombination führen.
Es könnten aber auch cDe und Cde zusammen kommen. Dann müsste es R0r' heißen.
Oder CDe und cDe - R'R0.
Das phänotypische Ergebnis ist in allen Fällen gleich. Die Person ist Rhesus D positiv und exprimiert auch C, c und e auf ihren Erythrozyten. Wie die Genotypen wirklich aussehen, lässt sich nur mit molekulargenetischen Methoden feststellen.
Und wie ist es eigentlich mit der Vererbung? Eine nette Fangfrage, um Assistenzärzte zum Schwitzen zu bringen: Können Rhesus D positive Eltern ein Rhesus D negatives Kind bekommen?
Damit jemand bei der serologischen Blutgruppenbestimmung Rhesus positiv getestet wird, muss nur bei einem der beiden Haplotypen das RHD-Gen exprimiert werden. Wenn wir nun das obere Beispiel für beide Eltern nehmen:
Mama und Papa: CcDee - wahrscheinlichste Kombination der Haplotypen: CDe und cde. Wenn das Kind von beiden Eltern den cde Haplotyp bekommt, ist es Rhesus D negativ.
Also ja, es geht! Und umgekehrt? Können Rhesus D negative Eltern ein Rhesus D positives Kind bekommen?
Nein, können sie nicht. Denn wo soll das Kind das RhD her haben?
Alles klar?
KINISCHE BEDEUTUNG
Das Rhesus D Antigen ist die häufigste Ursache für den Morbus hämolyticus fetalis oder neonatorum.
Seit der Einführung der Rhesus-Prophylaxe ist das Risiko einer Immunisierung auf ein Minimum gesunken. Es betrifft Frauen, die entweder die Impfung verweigern - glücklicherweise nur ganz selten, Impfversager - auch nur selten. Aber leider die grösste Gruppe bilden die Frauen, die ihr erstes Kind in einem Land zur Welt bringen, wo die medizinische Versorgung, wenn sie existiert, nur die Grundbedürfnisse abdeckt und keine Prophylaxe macht. Diese Frauen immunisieren sich meist bei der Geburt des ersten Kindes. Ist das zweite Kind ebenfalls Rhesus positiv, kommt es ab der 6-7 Woche zum Übertritt der fötalen Erythrozyten in der Kreislauf der Mutter. Diese Zellen exprimieren das D Antigen recht stark und führen bei der Mutter zur Boosterung des "schlummernden" anti-D aus der ersten Schwangerschaft.
Solche Schwangerschaften dürfen auf keinen Fall in einem "Wald und Wiesen" Krankenhaus betreut werden. Eine Schwangere mit einer aktiven Immunisierung gehört sofort in eine Risikoambulanz eines Schwerpunktkrankenhauses überwiesen. Es muss sich auch nicht immer um ein anti-D handeln, aber sobald festgestellt wurde, dass der gefundene Antikörper einen Morbus Haemolyticus Fetalis (MHF) verursachen kann, muss sie überwiesen werden. Bei den meisten "gefährlichen" Antikörpern, die durch Antigene der fetalen Erythrozyten geboostert werden, steigt auch während der Schwangerschaft der Titer an. Gerade das anti-D kann schon fast unglaubliche Höhen erreichen. Der Titer wird durch die Reaktion von D-positiven Zellen mit dem mütterlichen Serum gemessen. Das Serum wird in einer geometrischen Reihe immer 1:1 verdünnt (Verdünnungsfaktor: 1,2,4,8,16,32,64,128 usw.) Als Titerhöhe wird diese Verdünnung angegeben, die noch immer eine Agglutinationsstärke von 1 verursacht. In den meisten Laboratorien wird ab ca. 1000 gerundet, also 2000, 4000 usw. Mein "Rekord", den ich gesehen habe, war ein Titer von 120000. Das Serum der Mutter wurde also 1:120.000 (!!!) verdünnt und hatte noch immer eine anti-D Konzentration, die Rhesus-positive Zellen agglutinieren konnte. Das Kind war schwerst krank (MHF), wurde aber mit Hilfe von intrauterinen Transfusionen fast zeitgerecht und bis auf eine leichte Anämie mit Gelbsucht, gesund auf die Welt gebracht. Danach hatte es nicht mal eine Austauschtransfusion gebraucht, sondern lediglich ein paar Mehrstunden unter dem UV Licht.
Allerdings darf man sich auf die Titerhöhe nicht verlassen. Antikörper des Kell-Systems können ganz viel Schaden anrichten, obwohl der Titer nur bei 4 oder 8 liegt.
Natürlich gibt es Antikörper, die durch die Schwangerschaft entweder erst entstanden sind (anti-c, oder anti-E) oder wie z.B.: anti-M schon vor der Schwangerschaft da waren und die natürlich vorkommen. Bei solchen Frauen wird der Facharzt in der Spezialklinik entscheiden, wie die weitere Betreuung aussehen soll. Wichtig ist aber, dass diese Entscheidung von jemandem kommt, der täglich damit zu tun hat und nicht nur ein Buchwissen besitzt.
Besonders weil die Behandlung von Föten, die an einem Morbus haemolyticus fetalis erkrankt sind, sehr viel Erfahrung sowohl punkto Wissen, Diagnostik als auch Behandlungstechnik erfordert.
D-VARIANTEN
Das D-Antigen ist das größte Protein der erythrozytären Zellmembran, die es mit 12 Schleifen durchzieht. Aufgrund des Aufbaus nimmt man an, dass es sich um einen Transporter handelt - allerdings ist die wirkliche Aufgabe von D nicht endgültig geklärt.

Diese Illustration ist die berühmteste Abbildung des Rhesus D-Antigens. Jedes bunte Kügelchen zeigt eine Mutation. Es gibt eine Hypothese, dass Mutationen, die innerhalb der Membran lokalisiert sind, keine äusserlichen Veränderungen aufweisen und damit beim Trägern durch das reguläre D-Antigen, keine Antikörperbildung ausgelöst wird.
Allerdings ist es eine Hypothese, die nicht einfach zu beweisen ist. Durch die Regelung, dass alle D-Varianten Träger, mit Rhesus D negativen Blut versorgt werden müssen, kommt es nur sehr selten vor, dass sie doch Rhesus D positiv versorgt werden. Und auch beim D-Antigen kommt es nur selten zu einer Immunisierung mit Antikörperbildung.
Man braucht zwar nur einen Fall, bei dem die Antikörperbildung bei einer bestimmten Variante nachgewiesen wurde, um die Möglichkeit der Immunisierung zu bestätigen. Umgekehrt ist es viel schwieriger, weil eine fehlende Immunisierung bei einem Patienten, diese bei einem anderen nicht ausschliesst. Nur bei den häufigsten Varianten wie D weak Typ1, 2 und 3 hat man ausreichend Daten gesammelt, um mit ausreichender Sicherheit sagen zu könne, dass es bei ihren Trägern zu keiner Antikörperbildung kommt.
Vollständige Arbeit:
Genetik der Rhesus-Blutgruppensystems von Prof. Willy Flegel, Deutschen Ärzteblatt 10/2007
Das Protein zeigt einen hohen Polymorphismus, was zu abgeschwächten oder veränderten RhD-Antigenen führt. Früher hat man die Varianten in D weak oder partial D eingeteilt. D weak bedeutete eine verminderte Expression des normalen Antigens auf den Erythrozyten. Man nahm an, dass Patienten mit einem D weak durch ein normales D-Antigen nicht immunisiert werden können. Partial D war dagegen ein nur teilweise exprimiertes Antigen - es konnten Teile fehlen oder sie waren verändert. Wurde ein Patient mit einem partial D Rhesus positiv transfundiert, konnte er Alloantikörper gegen das normale Protein entwickeln.
Es wurde aber bald klar, dass diese Einteilung zu einfach war. Auch die D weak - Varianten können Veränderungen haben, die dann eben eine abgeschwächte Expression zur Folge hatten. Es gibt mittlerweile unzählige D-Varianten und es kommen ständig neue dazu. Sie werden seit Jahren auf der Rhesus-Site der Universität Ulm gesammelt.
Es gibt nur wenige D-Varianten, von denen man ausreichend sichere Daten hat, dass die Träger durch reguläres D nicht immunisiert werden können. Es sind die D weak Typ 1, 2 und 3. Patienten mit diesen Rhesus D - Varianten können Rhesus D positiv transfundiert werden und die Frauen brauchen in der Schwangerschaft keine Rhesusprophylaxe.
Alle anderen D-Varianten müssen RhD NEGATIV transfundiert werden und Schwangere mit einer D-Variante brauchen eine Rhesusprophylaxe.
Zusätzlich zu den gängigen Antigenen im Rhesussystem (C, D, E, c, e, Cw) gibt es über 50 weitere Antigene, die aber selten die Ausbildung eines Antikörpers verursachen.
REFERENZEN:
1. Rhesus Site. Franz F. Wagner, Willy A. Flegel. Transfus Med Hemother 2014;41:357–363
2. Genetik der Rhesus-Blutgruppensystems von Prof. Willy A. Flegel, Deutschen Ärzteblatt 10/2007
Zuletzt bearbeitet am 28.11.2023
