NIERENTRANSPLANTATION

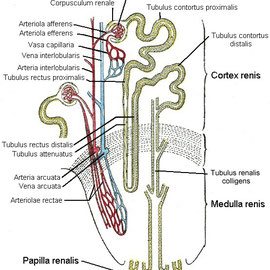
Die Niere ist ein paariges, fisolenförmiges Organ, welches ausserhalb des Peritoneum, im hinteren Teil der Bauchhöhle liegt und ca. 12-14 cm groß ist. Über die Harnleiter sind die Nieren mit der Blase verbunden. Eine Niere besteht aus einer Medulla und einem Kortex. Umschlossen ist sie von einer festen, fibrösen Kapsel.
Der funktionelle Baustein einer Niere, ist das Nephron - ein Blutfilter. Jede Niere enthält ca. 1.000.000 Nephrone.
Ein Nephron besteht aus dem Nierenkörperchen (Glomerulum in der Bowmanschen Kapsel), dem distalen und dem proximalem Tubus und der Henlen'schen Schleife.

HAUPTFUNKTIONEN DER NEPHRONE:
- Filtration
- Reabsorption
- Sekretion von Wasser und der darin gelösten Substanzen
DIE FÜNF PHYSIOLOGISCHEN FUNKTIONEN DER NIERE:
1. Ausscheidung von Abfallprodukten und Medikamenten
2. Aufrechterhaltung des Wasser-, Elektrolyt- und
Säurehaushalts.
3. Produktion von Hormonen einschließlich Renin zur
Regulierung des Blutdrucks
4. Bildung von Erythropoetin für die Bildung roter
Blutkörperchen
5. Und Umwandlung von inaktivem Vitamin D in aktives
Vitamin D, das für den Knochenstoffwechsel von
Bedeutung ist.
AUSFALL DER NIERENFUNKTION
Aus der Funktion der Niere können auch gleich Symptome bei Ausfall der Nierenfunktion abgeleitet werden.
1. Es kommt zur Ansammlung von Abfallprodukten aus dem physiologischen Stoffwechsel und aus dem Abbau von Schadstoffen
wie Medikamente. Im Extremfall führt es zur Urämie, urämischem Koma oder Urosepsis.
2. Weiters kommt es zur Wasserretention mit Ödemen und Bluthochdruck, der durch den Ausfall von Renin weiter
verschlechtert wird.
3. Das Fehlen von Erythropoetin führt zur renalen Anämie.
4. Das Fehlen von Vitamin D führt zur Osteoporose.
WIE UNTERSUCHT MAN DIE NIERE:
1. Nierenfunktionsparameter (Laborwerte):
- (Blut) Kreatinin: ist ein Abbauprodukt der Säure Kreatin, welche die Muskeln mit Energie versorgt. Ca. 2% werden täglich
über die Niere ausgeschieden. Normalwerte sind: 0,5 - 1,1 mg/dl.
- (Blut) Glomeruläre Filtrationsrate (GFR) ist ein Maß der renalen Clearance von Kreatinin. Es sagt, welches Plasmavolumen
in einem definierten Zeitrahmen durch die Nierenglomeruli von Kreatinin befreit wurde. Normalwerte sind vom
Alter abhängig. Sind aber bei Erwachsenen zwischen 90 - 120 ml/min.
- (Urin) im Urin können alle möglichen Substanzen gemessen werden wie Glucose, Eiweiß, Erythrozyten, Leukozyten,
Bakterien, pH-Wert.
2. Nieren-CT/Ultraschall:
damit können strukturelle Fehler in der Niere darstellen - Zysten, Tumore, Hydronephrose, Schrumpfnieren.
3. Nierenbiopsie:
- ultraschall-gezielt wird mit einer Nadel, ein kleiner Nierenzylinder entnommen, der histomorphologisch untersucht werden
kann.
AB WANN IST DIE NIERENFUNKTION EINGESCHRÄNKT:
Die Einschränkung der Nierenfunktion wird in fünf Stadien eingeteilt:
Stadium I hat noch keine Einschränkung der GFR, aber pathologische Befunde in der Bildgebung oder Urinstatus (Eiweiß)
Stadium II: 60–89 ml/min geringgradiger Funktionsverlust
Stadium III: 30–59 ml/min mittelgradiger Funktionsverlust
Stadium IV: 15–29 ml/min schwerer Funktionsverlust
Stadium V: < 15 ml/min bedeutet Nierenversagen
Außerdem kann auch noch zwischen einem chronischen und einem akuten Nierenversagen unterschieden werden. Ein chronisches Nierenversagen kommt schleichend und mit unspezifischen Symptomen. Ein akutes Nierenversagen kann dagegen sehr schnell lebensgefährlich werden. Viele Intensivpatienten entwickeln in der kritischen Behandlungsphase ein akutes Nierenversagen, welches mit Hämodialyse behandelt werden muss, aber nach Abklingen der Grunderkrankung wieder verschwindet.
WAS FÜHRT ZUM NIERENVERSAGEN?
Es kann zwischen prärenalen, renalen und postrenalen Ursachen differenziert werden.
Die klassische prärenalen Ursache ist eine Minderdurchblutung der Niere - durch zu geringe Flüssigkeitszufuhr, Flüssigkeitsverluste (Erbrechen, Durchfall) oder Blutverluste. Auch Hypertonie würde ich zu den prärenalen Ursachen zählen, auch wenn es mit der Zeit direkt die Niere schädigt und zur renalen Ursache wird. Bei postrenalen Ursachen sind es Obstruktionen, die zum Harnrückstau und dadurch zur Schädigung der Nierentubuli (Nephrone) führen.
Im Kindesalter sind es vor allem angeborene Fehlbildungen, die eine Nierenersatztherapie notwendig machen.
Bei jungen Erwachsenen ist es Diabetes Typ I und bei später auftretenden Nierenschäden sind es Bluthochdruck und Diabetes mellitus Typ II, welche als Hauptursache gesehen werden können.
Weitere Ursachen für Nierenschäden sind Erkrankungen aus dem Rheumatischen Formenkreis, nierentoxische Medikamente und Zystennieren.
THERAPIE:
Spätestens ab Stadium V kann man ohne Dialyse (Blutwäsche) nicht mehr überleben. Allerdings ersetzt diese nur die Ausscheidungsfunktion der Nieren. Die Patienten leiden an Anämie, Bluthochdruck und Knochenbrüchigkeit. Das muss mit mehreren Medikamenten behandelt werden. Und der Patient ist auch an das Dialysezentrum und die Dialysetermine gebunden. Es ist eine sehr große Einschränkung und man versucht mit einer Transplantation alle Nierenfunktionen wieder herzustellen.
Leider kann nicht jeder Patient transplantiert werden. Auch wenn man den Organmangel außer Acht lässt, gibt es für eine Transplantation einige klare Kontraindikationen. Eine aktive Tumorerkrankung würde sich durch die obligatorische Einnahme von Immunsuppressiva nach einer Nierentransplantation sehr verschlechtern. Und der Patient würde schnell daran versterben.
Eine weitere Kontraindikation ist eine schlechte kardiale Situation des Patienten. Eine Nierentransplantation ist ein langer operativer Eingriff und dieser würde das Herz bei manchen Patienten zu sehr belasten.
Daher müssen alle Patienten, die auf die Nierenwarteliste gemeldet werden sollen, von sehr vielen Fachdisziplinen erst mal freigegeben werden. Dazu gehört eine kardiale und pulmonale Abklärung, eine internistische Freigabe inklusive Tumorausschluss, HNO-Abklärung, dermatologische und zahnärztliche Begutachtung und manchmal eine psychologische Begutachtung, ob der Patient die Tragweite des Eingriffs begreift und ob er bereit ist, die lebenslange Immunsuppression einzunehmen.
Möglicherweise habe ich eine Fachrichtung vergessen, aber der Punkt ist, vor der Transplantation muss man sich sicher sein, dass eine Transplantation für den Patienten wirklich die beste Option darstellt.
Wenn diese Untersuchungen alle abgeschlossen sind, muss noch die immunologische Abklärung abgewartet werden, bevor der Patient auf die Warteliste gemeldet wird.
AUFNAHME AUF DIE WARTELISTE:
Sobald es klar ist, dass der Patient auf die Warteliste kommt, wird eine 1-Feld HLA-Typisierung der Loci A, B, C, DR und DQ gemacht. Dafür benötigen wir nur ein kleines EDTA-Blutröhrchen. Die Typisierung wird mittels SSO gemacht - mehr dazu auf der Seite über immungenetische Methoden.
Aber mindestens genauso wichtig ist der immunologische Status/Anamnese: hat der Patient/die Patientin bereits Immunisierungsereignisse, welche zu einer Bildung von Antikörpern gegen fremde HLA-Merkmale geführt haben?
Bei Männern, die zum ersten Mal eine Niere bekommen und keine Transfusionen bisher erhalten haben, findet man nur ganz selten spezifische HLA-Antikörper. Wie wir das Serum eines Patienten auf HLA-Antikörper untersuchen, ist ebenfalls auf der Seite über immungenetische Methoden beschrieben.
Schwieriger wird es schon bei Frauen, welche bereits Kinder geboren haben. Viele Frauen entwickeln während der Schwangerschaft Antikörper gegen Gewebsmerkmale des Kindes, die nicht von ihr selbst, sondern dem Kindesvater stammen. Das hat an sich keinen Krankheitswert, wird aber vor einer Transplantation zu einer Hürde. Da sie bereits gegen diese Merkmale nun immunisiert ist, sollte sie nicht noch einmal mit ihnen in Kontakt treten. Wir nennen sie die Repeated Mismatch. Wenn sie im Luminex Single Antigen Test eine Stärke von 1000 MFI erreichen, werden sie für die Transplantation verboten.
Aber auch wenn Antikörper gegen Antigene des Kindesvaters nur mal früher nachweisbar waren, jetzt aber nicht mehr, sollte man nicht dagegen transplantieren, da es durch die B-Gedächtniszellen zu einer späten antikörpermedierten Organabstoßung führen kann.
Niere gehört zu den Organen, wo diese "verbotenen Gewebsmerkmale" (UNAg, unacceptable antigens) bei Eurotransplant gemeldet werden müssen und wo sie bei der Allokation automatisch berücksichtigt werden.
WAS BEDEUTEN VERBOTENE ANTIGENE (UNAg) FÜR DEN PATIENTEN?
Durch die Definition von UNAg, vor allem, wenn deren Antikörper auch zytotoxisch sind, also nicht nur im Luminex Single Antigen gemessen werden können, kann eine akute Organabstoßung vermieden werden.
Gleichzeitig schränkt es natürlich den Spenderpool ein - alle Spender, die ein UNAG tragen, dürfen für den Patienten nicht spenden. Das kann in Prozent als virtuel panel reactive antibodies (vPRA) berechnet werden.
Dieser Wert sagt wieviel Prozent der potenziellen Spender (also theoretisch der allgemeinen Bevölkerung) nicht kompatibel wären. Ist zum Beispiel bei einem Patienten HLA-A2 als UNAg definiert, hat er einen vPRA von 50% - 50% der europäischen Bevölkerung sind A2 positiv.
Auf der Webseite von ETRL (Eurotransplant Reference Laboratory) gibt es verschiedene Rechner, mit denen man die Häufigkeit der passenden Spender in verschiedenen Konstellationen berechnen kann - unter anderem den vPRA-Rechner.
PASSENDES ORGAN:
Was bedeutet das eigentlich? Zunächst einmal ist passend nicht gleich ident. Natürlich wäre ein HLA-identes Organ die beste Option. Aber die Wahrscheinlichkeit ein identes Organ von einem Fremdspender zu bekommen ist sehr gering. Bei Organtransplantationen heißt also passend vor allem, dass der Empfänger keine Antikörper gegen die Gewebsmerkmale des Spenders hat. Bei einer Lebendspende ist es aus immunologischer Sicht das einzige Kriterium, um ein Organ als kompatibel zu bezeichnen. Auch wenn der der Spender völlig unterschiedliche HLA-Antigene wie der Empfänger hat, kann eine Niere oder eine Leber transplantiert werden. Das ist auch der Grund, warum Eheleute füreinander eine Niere spenden können. Die Wahrscheinlichkeit dem Ehepartner Stammzellen spenden zu können, liegt praktisch bei Null - hier braucht man eine möglichst hohe Übereinstimmung.
Bei einer Cadaverspende gibt es die "minimal matching criteria" von Eurotransplant. Dabei müssen Spender und Empfänger zumindest einen gemeinsamen B- und DR-Lokus oder beide DR-Loci haben.
AM-PROGRAMM:
Hochimmunisierte Patienten, die nur eine sehr geringe Möglichkeit haben, über die normale Allokation ein kompatibles Organ zu bekommen, können in das Acceptable Mismatch (AM) Programm aufgenommen werden. Dabei werden Antigene festgelegt, die als Mismatch akzeptiert werden können. Diese Antigene werden dann wie die eigenen HLA-Antigene eines Patienten bei der Allokation gewertet. Zusätzlich werden die "minimal matching criteria" auf ein DR-Lokus reduziert.
TRANSPLANTATION:
Die Transplantation kann nur nach einem negativen Crossmatch durchgeführt werden. Allerdings können auch noch andere Kriterien im Weg stehen. Gerade in der Pandemie-Zeit haben einige Patienten wieder nach Hause fahren müssen, weil der Corona-Test bei der Aufnahme positiv war.
Im Gegensatz zu den meisten anderen Organen, wird eine Niere nicht anstelle der eigenen Niere transplantiert. In der Regel bleiben die eigenen Organe drinnen - außer es gibt medizinische Gründe, um diese zu entfernen, wie Infektionen oder Tumore. Die neue Niere kommt in den Unterbauch. Hier kann der Gefäßanschluss an die Iliakalgefäße leicht hergestellt werden.
Eine transplantierte Niere sollte sofort ihre Funktion aufnehmen und Harn produzieren.
Gleichzeitig würde aber das Immunsystem sofort versuchen, das fremde Organ zu eliminieren, daher muss auch gleich nach der Transplantation mit der Immunsuppression begonnen werden. Und diese muss Lebenslang fortgeführt werden.
Zuletzt bearbeitet am 04.11.2023